Существует множество различных подходов к исправлению генетических ошибок. Как правило, такие методы лечения заканчиваются иммунологическими или генетическими побочными эффектами.
Принцип воздействия генной терапии
Генная терапия заключается в том, что в нужные клетки вводится корректирующий ген для модификации клеток пациента. Корректирующий ген транспортируется при помощи вирусов. Для органа-мишени выбирается необходимое количество вируса. Если количество слишком велико, то может подключиться иммунная система. Вдобавок к этому корректирующий ген не всегда может правильно определить место воздействия.
Поэтому было предложено использовать CAR-T-терапию. CAR — Chimeric antigen receptor — химерный рецептор антигена — это специально разработанное белковое соединение, которое состоит из разных частей, полученных из разных источников. Это белковое соединение, например, может обнаружить раковые клетки и инициировать их разрушение. При помощи CAR-T-терапии иммунная система не начинает своей разрушительной деятельности против медикамента.

Фатальные ошибки прошлого
Инъекции корригирующих генов транспортируется «обезвреженными» вирусами. Они больше не могут размножаться и не вызывают никаких заболеваний. Но всё-таки, иммунная система начинает борьбу даже с этими безобидными вирусами.
Таким образом, чтобы обеспечить достаточное количество клеток с корригирующим геном, врачи использовали слишком большую дозу препарата, что бы иммунная система не убила всю дозу медикамента. И в одном случае организм с этим не справился.
Это произошло с Джесси Гелсингером, его судьба бросает тень на историю генной терапии. 18-летний молодой человек страдал лёгкой формой метаболического расстройства печени. В 1999 году он согласился пройти новый метод лечения генной терапии и умер в течение четырёх дней. Его иммунная система не выдержала потока вирусов.
Учёные и сегодня ещё не могут точно предсказать, когда интеграция корригирующего гена может иметь фатальные последствия. Например, в период с 2006 по 2009 год десять детей с врожденным иммунодефицитом были успешно вылечены, но только спустя несколько лет удалось устранить побочные эффекты после лечения.
У семи детей развился рак крови. Вирусы стабильно поставляли корригирующий ген, который спас их от основного заболевания, но этот же корригирующий ген активировал развитие рака.
Генная терапия сегодня
С тех пор генная терапия ушла далеко вперёд. Корригирующие гены меньше влияют на гены справа и слева от места вставки, тем самым снижая риск лейкемии. Помимо этого стали использовать другую группу вирусов — аденоассоциированные вирусы. Это слабые вирусы, которые не вызывают болезни у человека, а соответственно и не вызывают такой сильной реакции иммунной системы.

Недостаток в том, что этот вирус только переносит корректирующий ген, но не вставляет его в генную цепочку. Поэтому лечебный эффект остаётся не стабильным.
Гендерная терапия Luxturna
Luxturna одобрена в США в декабре 2017 года, использует такой вирус для лечения серьезных заболеваний глаз. Пациенты чаще всего страдают врождённой слепотой или страдают ахроматопсией, то есть не распознают цвета, потому что мутация в гене RPE-65 разрушает сетчатку.
Врачи вводят препарат непосредственно в глаз, где ген транспортирует интактный выпуск RPE-65 в сетчатку. Пациенты хорошо переносят терапию, а иногда хотят вылечить второй глаз. Это обнадёживает и вселяет надежду, что генная терапия уже может использоваться и получит дальнейшее развитие.
Профессор Биргит Лоренц из Университета Гиссена дал обзор состояния исследований генной терапии на глазу на пресс-конференции в преддверии ежегодного конгресса Немецкого офтальмологического общества в Берлине. Первый препарат для генной терапии наследственной болезни сетчатки появился спустя десять лет после начала исследований.
Проверенный препарат был подан с одобрения Spark Therapeutics в США и запущен в производство с марта 2018 года под торговым названием Luxturna ™.
Как работает Luxturna?
Luxturna исправляет дефект в гене RPE65. Он необходим для рециркуляции активного визуального пигментного родопсина в эпителии пигмента сетчатки. В отсутствие RPE65 дистрофия сетчатки возникает в раннем детстве, что приводит к прогрессирующей потери зрения и часто полной слепоте до достижения возраста 20 лет. Болезнь очень редка.
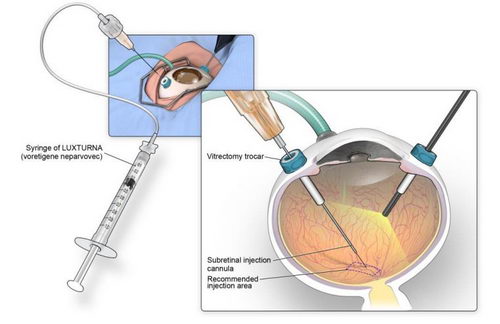
Генная терапия не может оживить мертвые сенсорные клетки, но она замедляет прогрессирование заболевания. На сегодняшний день около 150 пациентов разных стран мира прошли лечение. Были достигнуты функциональные улучшения, которые в основном касаются улучшения зрения в условиях низкой освещенности и улучшения остроты зрения.
Почему глаза?
Глаз хорошо подходит для генной терапии по двум причинам.
- Во-первых, в субретинальном пространстве, в промежутке между пигментным эпителием и фоторецепторами, нет ни кровеносных, ни лимфатических сосудов, поэтому нет страха перед иммунной реакцией.
- Во-вторых, клетки там не обновляются, поэтому корригирующий ген должен вводиться только один раз.
В описанных сегодня генных терапиях функциональный ген либо упаковывается в оболочки рекомбинантных адено-ассоциированных вирусов, либо в лентивирусах. Затем эти генные челноки вводят либо под сетчатку, либо в стекловидное тело в зависимости от типа клеток-мишеней.

Хотя наследственные заболевания сетчатки редки, у этих пациентов раньше не было возможностей для терапии. Ген RPE65 является лишь одним из 250 генов, в которых мутации были идентифицированы как триггеры для одного из этих заболеваний. В принципе, моногенные заболевания, то есть те, которые основаны на одной генной мутации, пригодны для генной терапии.
Лечение рака
В последнее время учёные пытаются вылечить при помощи генной терапии некоторые виды рака. Использование CAR-Т-клеток показывает хорошие результаты при клинических испытаниях против лейкемии и лимфомы.
Целью этой терапии является целенаправленное уничтожение раковых клеток с помощью собственных Т-клеток организма, основных игроков иммунной системы. Однако, в отличие от других видов генной терапии, никакой генетический дефект здесь не исправляется, а добавляется дополнительный ген.
- Врачи сначала берут Т-клетки от пациентов, затем в них включают ген для «химерного рецептора антигена» (CAR) и возвращают модифицированные Т-клетки донорам.
- CAR, полученный Т-клетками, затем обнаруживает раковые клетки с помощью специфических структур распознавания.
- Часть CAR, которая выступает с поверхности иммунных клеток, может рассматриваться как кусок головоломки.
- Теперь, когда Т-клетки патрулируют тело, а кусочек головоломки находит свой аналог — специфический антигенный белок на поверхности раковой клетки — он инициирует разрушение опухолевой клетки.
Преимущества лечения рака клеточной терапией
Клеточная терапия CAR-T решает основную проблему терапии рака: раковые клетки видоизменяются со временем, чтобы стать невидимыми для иммунной системы. Т-клетки CAR выявляют их и снова делают их видимыми.
Иконой этой терапии является Эмили Уайтхед. У неё был диагностирован неизлечимый лейкоз в возрасте шести лет, но её вылечили.
Однако этот пример не должен скрывать тот факт, что терапия CAR-T-клеток иногда имеет серьезные побочные эффекты. CAR-T-клетки являются очень мощным механизмом, который может привести к эффективной терапии, а также к срыву иммунной системы, что один раз в случае с Джесси Гелсингером закончилось летальным исходом.
Исследования методов генной терапии методами редактирования генома, особенно CRISPR / Cas, набирают огромные обороты. Использование гена-ножниц делает огромный шаг вперед, который поможет избежать неприятных побочных эффектов. Кроме того, методы редактирования генома могут не только добавлять или инактивировать гены, но могут специально «ремонтировать» их.
Но даже ножницы имеют недостатки. Время от времени они отсекали не то, что от них ожидалось. Эти приводило к новым побочным эффектам.
Генная терапия остаётся многообещающим методом лечения, но все еще находится в зачаточном состоянии. У нас еще нет многолетнего опыта, и мы знаем, что некоторые проблемы появляются только через несколько лет.
Лечение СПИДа
Тони Катомен, директор Института трансфузионной медицины и генной терапии в Университете Фрайбурга хочет вылечить СПИД при помощи генной терапии. Из-за мутации в гене CCR5 вирус HI попадает в клетку и становится устойчивой к ВИЧ. Инактивируя ген CCR5 в стволовых клетках крови, пациенты могут разработать новую, устойчивую к ВИЧ иммунную систему. Этот подход уже был успешным в экспериментах на животных, и клинические исследования планируется на 2019 год.
По мере уменьшения биологических барьеров возникают другие проблемы. Некоторые из них этические, другие — денежные: генная терапия чрезвычайно дорога. Luxturna стоит около 850 000 долларов США. Фармацевтические компании оправдывают цены высокими расходами на разработку.
Наверное, здесь надо вмешаться политикам. Несмотря на то, что таких больных не так много в мире, всё-таки излечение от слепоты делает пациента дееспособным. Возвращение к полноценной жизни всегда оправдывает любые денежные затраты.

Оставить комментарий